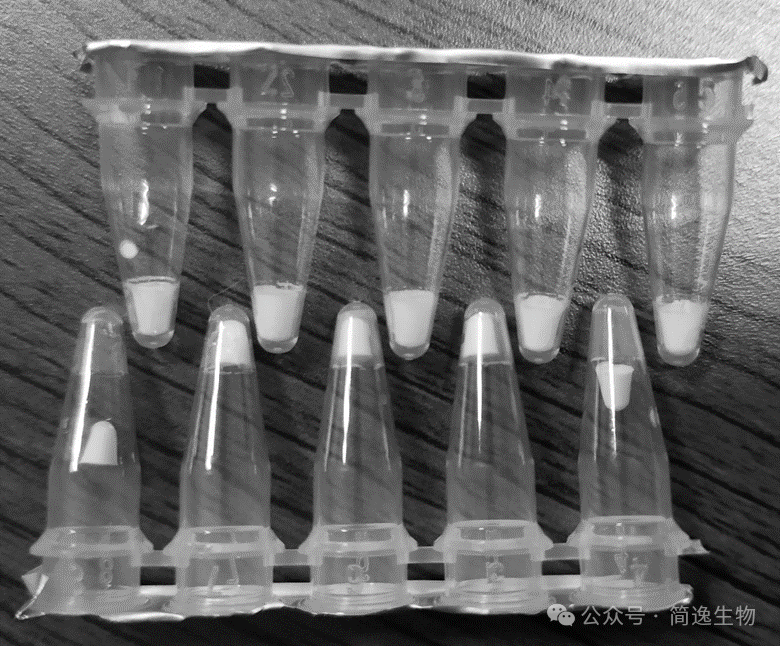
第三章 IVD试剂冻干(第四节 冻干微芯:IVD试剂的理想选择之一)

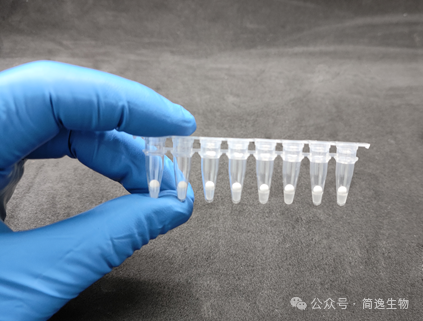
体外诊断(IVD)检测过程通常包含以下步骤:试剂添加与配置、样本添加、反应、数据读取与处理。在整个检测流程中,仪器性能是结果准确性的基础保证,而试剂的质量及样本处理水平则是决定检测结果可靠性的关键影响因素。
传统试剂的挑战
·液体试剂:
其性能和稳定性高度依赖冷链储运和严格的实验室管理。在存储、运输和使用环节,存在蛋白质变性、微生物污染、pH值变化等风险,且加液精度也会直接影响检测准确性。
·传统冻干试剂:
解决了运输稳定性问题,但使用便捷性不足(需溶解复融),溶解过程本身可能引入误差或污染风险。单份独立包装的在位冻干试剂,虽提高了便利性,但在生产环节常面临批间差异控制难度大、生产效率偏低、成本较高等挑战。

冻干微芯的差异化优势
相比之下,冻干微芯(如冻干球)技术因其独特设计,优势显著:

生产过程可实现每份试剂精度的均一控制,采用流水线作业,显著提升批间一致性。
上述特性使得检测过程对仪器精度和操作人员水平的依赖性大幅降低。
电镜扫描显示,急速冷冻(如滴入-196℃液氮瞬间)赋予冻干微芯高刚性、致密的外壳结构。这有效防止脱落掉粉,避免了潜在的试剂污染和损失。
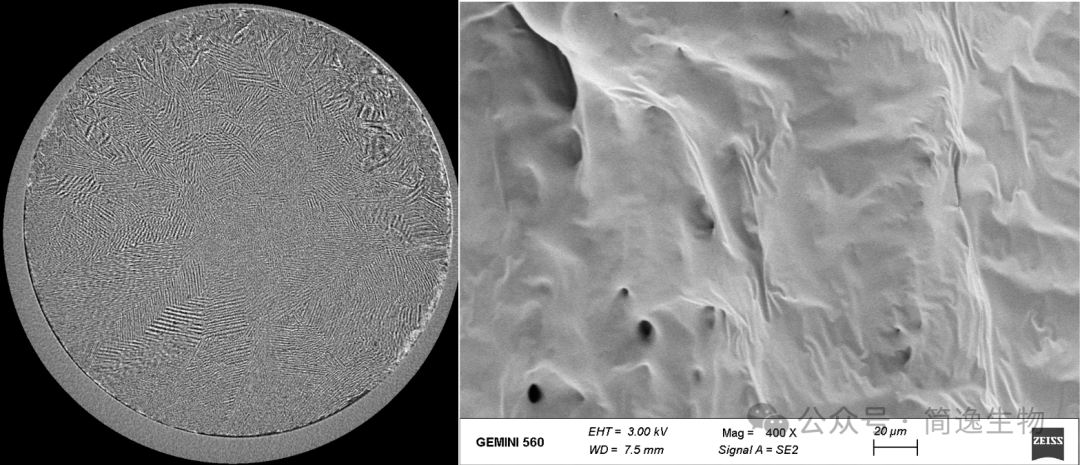
内部结构均匀一致,结合优化的冻干保护剂配方,能充分保留蛋白质等生物分子的空间构象,确保长期保存过程中性能稳定,防止劣化。
在有效避光、隔绝氧气的条件下,其有效期显著延长。实验数据表明,即使在长达5-6年的存储后,其性能仍可保持初始水平。
支持多组分(如引物探针、酶、dNTPs、缓冲盐等)稳定共存于单一微芯。操作时仅需简单加样溶解即可,大幅简化现场检测流程(如POCT)。
·常温储运: 无需依赖冷链,节省相关的物流与管理成本。
·高精度与稳定性: 保障检测结果的高准确性与可靠性。
·提升整体效率: 综合简化了存储、运输和使用环节,有效提升整体实验效率。
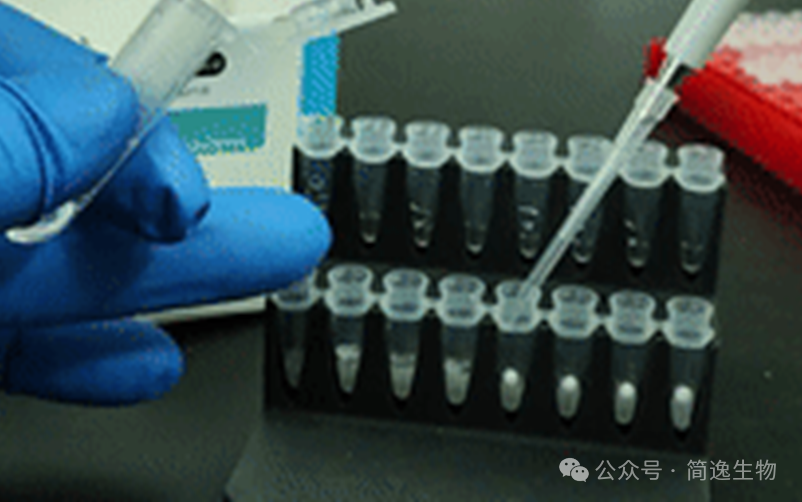
冻干微芯的技术原理与工艺挑战:
冻干微芯的核心是快速冷却(如液氮滴冻)与冷冻干燥技术的结合:

·形成原理: 液体试剂滴入超低温介质(如液氮,-196℃)实现瞬间极速降温,形成均一的球状固体。
物理状态变化与挑战
·热应力:因试剂球表面与心部温差导致收缩不均,可能引起变形。
·组织应力:相变过程中体积膨胀(约4%)与未转变区域的相互作用,可能引发开裂。
·应力控制:通过优化冻干保护剂成分、精确控制溶液初始温度可缓解变形/开裂;后续的退火(常被类比为材料学的回火)工艺可释放内部应力,调节韧性与强度的平衡,提高试剂稳定性。但退火温度需精准测定,且不同生物原料的最佳参数差异显著,是工艺开发的核心难点之一。
快速冷却的作用机制
·抑制晶粒/冰晶长大:极速冷却使晶粒/冰晶生长时间不足,保留细小结构,提升物理强度。
·增加过冷度:加快冷却速度增大过冷度,增强形核驱动力,晶核数量增多,最终结构更细小致密。
·抑制原子扩散:降低原子扩散能力,抑制相变和晶界迁移,尤其有利于保持蛋白质等生物分子的活性。
产业化挑战与应对
尽管优势明显,冻干微芯的产业化也面临更高要求:
需筛选能维持外壳致密性、刚性并有效保护生物活性的特殊冻干保护剂配方。
液滴生成(精度受液体密度、粘度、环境影响)、快速降温(相变应力可能影响蛋白活性)、冻干工艺优化等环节干扰参数多,产品开发难度大。
微芯结构增加了与氧气的接触面,冻干品易吸潮,对分装环境(湿度、惰性气体保护)和包装密封性要求极高。
工艺步骤多,微小液滴操作需高度自动化以减少人为干扰和环境暴露风险。
·涉及质量风险点多(可达30+项),验证工作量大。
·酶等活性原料与冻干工艺的筛选匹配极具挑战。
·设备选型与交叉学科知识(生物、材料、工程)要求高。
·验证体系和质控标准(如含水量、分装环境)建设复杂,需投入大量人力物力。环节风险(出箱条件、SOP偏离、包材不合格等)控制是产品质量的关键,也是成本较高的主因。
产业化协同
当前,积极的产业化协同已初步形成:
· 标准化原料出现:“冻干微芯 Mix”(预混好的冻干粉/球核心组分)已成为标准原料产品,用户只需适配自身体系即可研发,大幅缩短周期。
·质量标准逐步建立:行业共识和标准正不断完善。
因此诞生了基于产业协同的冻干试剂新方案。企业无需购买冻干设备,也无需专门配置相关人员,原有的生产体系无需做出任何改变。只需分装检测项目的特殊组分并干燥,把冻干Mix组装,即可完成完整的试剂盒。冻干Mix已有严格的质量标准,实现规模化、标准化生产,能够确保产品批间一致性,热稳定性也更有保障。企业无需高投入,就能将普通试剂转化为冻干试剂。整个过程极为简便,无需复杂的冻干生产线,也无需专业的制剂人员。只需轻松两步:先将引物干燥在管中,再装入冻干微芯Mix,就能得到性能卓越的冻干型检测试剂。这种方式不仅符合法规要求,而且高效便捷,为体外诊断冻干型试剂的研发开启了全新篇章。

总结与建议
冻干微芯技术凭借其优异的稳定性、便捷性和常温储运优势,为解决传统IVD试剂痛点提供了理想方案,尤其在分子POCT(如RT-LAMP)领域前景广阔。虽然其工艺开发复杂、产业化门槛高、成本相对较高,但随着核心原料标准化、质量体系完善和标准的冻干微芯Mix原料的成熟,这些挑战正逐步被克服。技术的革新往往伴随着用户习惯的改变过程,冻干微芯有望在提升检测效率、准确性和可及性的新场景中实现突破,成为推动IVD行业发展的重要


体外诊断(IVD)检测过程通常包含以下步骤:试剂添加与配置、样本添加、反应、数据读取与处理。在整个检测流程中,仪器性能是结果准确性的基础保证,而试剂的质量及样本处理水平则是决定检测结果可靠性的关键影响因素。
传统试剂的挑战
·液体试剂:
其性能和稳定性高度依赖冷链储运和严格的实验室管理。在存储、运输和使用环节,存在蛋白质变性、微生物污染、pH值变化等风险,且加液精度也会直接影响检测准确性。
·传统冻干试剂:
解决了运输稳定性问题,但使用便捷性不足(需溶解复融),溶解过程本身可能引入误差或污染风险。单份独立包装的在位冻干试剂,虽提高了便利性,但在生产环节常面临批间差异控制难度大、生产效率偏低、成本较高等挑战。

冻干微芯的差异化优势
相比之下,冻干微芯(如冻干球)技术因其独特设计,优势显著:

生产过程可实现每份试剂精度的均一控制,采用流水线作业,显著提升批间一致性。
上述特性使得检测过程对仪器精度和操作人员水平的依赖性大幅降低。
电镜扫描显示,急速冷冻(如滴入-196℃液氮瞬间)赋予冻干微芯高刚性、致密的外壳结构。这有效防止脱落掉粉,避免了潜在的试剂污染和损失。

内部结构均匀一致,结合优化的冻干保护剂配方,能充分保留蛋白质等生物分子的空间构象,确保长期保存过程中性能稳定,防止劣化。
在有效避光、隔绝氧气的条件下,其有效期显著延长。实验数据表明,即使在长达5-6年的存储后,其性能仍可保持初始水平。
支持多组分(如引物探针、酶、dNTPs、缓冲盐等)稳定共存于单一微芯。操作时仅需简单加样溶解即可,大幅简化现场检测流程(如POCT)。
·常温储运: 无需依赖冷链,节省相关的物流与管理成本。
·高精度与稳定性: 保障检测结果的高准确性与可靠性。
·提升整体效率: 综合简化了存储、运输和使用环节,有效提升整体实验效率。

冻干微芯的技术原理与工艺挑战:
冻干微芯的核心是快速冷却(如液氮滴冻)与冷冻干燥技术的结合:

·形成原理: 液体试剂滴入超低温介质(如液氮,-196℃)实现瞬间极速降温,形成均一的球状固体。
物理状态变化与挑战
·热应力:因试剂球表面与心部温差导致收缩不均,可能引起变形。
·组织应力:相变过程中体积膨胀(约4%)与未转变区域的相互作用,可能引发开裂。
·应力控制:通过优化冻干保护剂成分、精确控制溶液初始温度可缓解变形/开裂;后续的退火(常被类比为材料学的回火)工艺可释放内部应力,调节韧性与强度的平衡,提高试剂稳定性。但退火温度需精准测定,且不同生物原料的最佳参数差异显著,是工艺开发的核心难点之一。
快速冷却的作用机制
·抑制晶粒/冰晶长大:极速冷却使晶粒/冰晶生长时间不足,保留细小结构,提升物理强度。
·增加过冷度:加快冷却速度增大过冷度,增强形核驱动力,晶核数量增多,最终结构更细小致密。
·抑制原子扩散:降低原子扩散能力,抑制相变和晶界迁移,尤其有利于保持蛋白质等生物分子的活性。
产业化挑战与应对
尽管优势明显,冻干微芯的产业化也面临更高要求:
需筛选能维持外壳致密性、刚性并有效保护生物活性的特殊冻干保护剂配方。
液滴生成(精度受液体密度、粘度、环境影响)、快速降温(相变应力可能影响蛋白活性)、冻干工艺优化等环节干扰参数多,产品开发难度大。
微芯结构增加了与氧气的接触面,冻干品易吸潮,对分装环境(湿度、惰性气体保护)和包装密封性要求极高。
工艺步骤多,微小液滴操作需高度自动化以减少人为干扰和环境暴露风险。
·涉及质量风险点多(可达30+项),验证工作量大。
·酶等活性原料与冻干工艺的筛选匹配极具挑战。
·设备选型与交叉学科知识(生物、材料、工程)要求高。
·验证体系和质控标准(如含水量、分装环境)建设复杂,需投入大量人力物力。环节风险(出箱条件、SOP偏离、包材不合格等)控制是产品质量的关键,也是成本较高的主因。
产业化协同
当前,积极的产业化协同已初步形成:
· 标准化原料出现:“冻干微芯 Mix”(预混好的冻干粉/球核心组分)已成为标准原料产品,用户只需适配自身体系即可研发,大幅缩短周期。
·质量标准逐步建立:行业共识和标准正不断完善。
因此诞生了基于产业协同的冻干试剂新方案。企业无需购买冻干设备,也无需专门配置相关人员,原有的生产体系无需做出任何改变。只需分装检测项目的特殊组分并干燥,把冻干Mix组装,即可完成完整的试剂盒。冻干Mix已有严格的质量标准,实现规模化、标准化生产,能够确保产品批间一致性,热稳定性也更有保障。企业无需高投入,就能将普通试剂转化为冻干试剂。整个过程极为简便,无需复杂的冻干生产线,也无需专业的制剂人员。只需轻松两步:先将引物干燥在管中,再装入冻干微芯Mix,就能得到性能卓越的冻干型检测试剂。这种方式不仅符合法规要求,而且高效便捷,为体外诊断冻干型试剂的研发开启了全新篇章。

总结与建议
冻干微芯技术凭借其优异的稳定性、便捷性和常温储运优势,为解决传统IVD试剂痛点提供了理想方案,尤其在分子POCT(如RT-LAMP)领域前景广阔。虽然其工艺开发复杂、产业化门槛高、成本相对较高,但随着核心原料标准化、质量体系完善和标准的冻干微芯Mix原料的成熟,这些挑战正逐步被克服。技术的革新往往伴随着用户习惯的改变过程,冻干微芯有望在提升检测效率、准确性和可及性的新场景中实现突破,成为推动IVD行业发展的重要力量。